
W Internecie krąży żart, że chemia jest jak gotowanie, tylko nie wolno lizać łyżki. To jak najbardziej słuszne podejście – w laboratorium chemicznym należy zachowywać ostrożność. Dwie naczelne zasady laboratoryjnego BHP to: 1) każdy odczynnik chemiczny traktujemy jako potencjalnie szkodliwy i w żadnym razie nie smakujemy go; 2) w laboratorium nie wolno niczego jeść ani pić – w tym celu należy przejść do oddzielnego pomieszczenia po uprzednim umyciu rąk.
Skoro szkolenie BHP mamy już za sobą, to przejdźmy do rzeczy. W maju przeleciał przez Facebooka następujący obrazek:
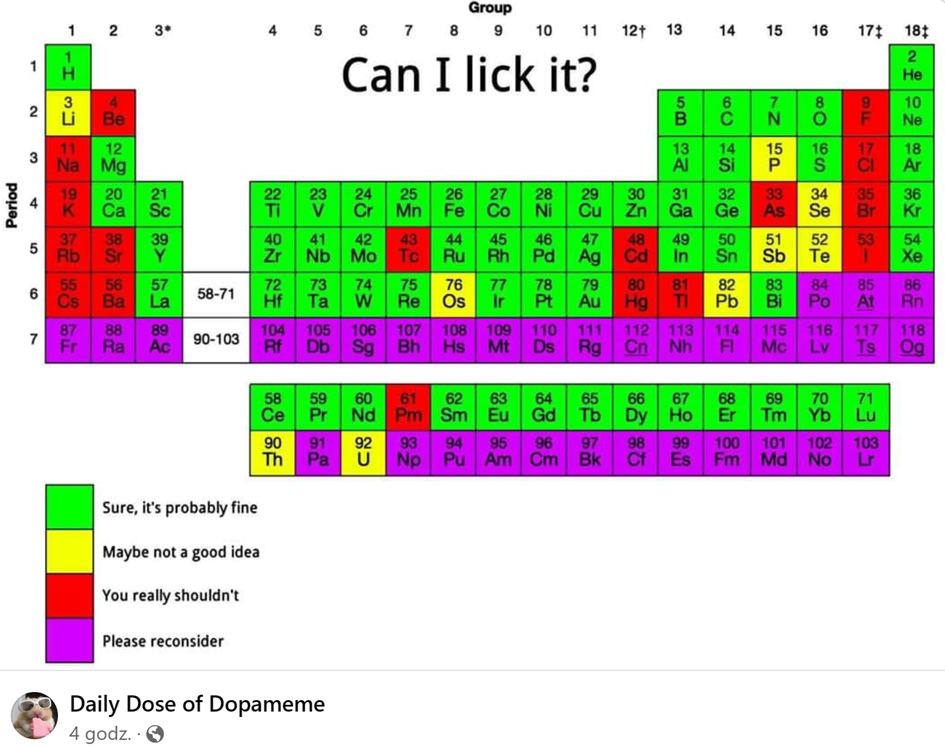
Jest to układ okresowy pierwiastków w dość niecodziennej wersji „Czy mogę to polizać?”. (Większą część tego wpisu stanowi zbiór chemicznych ciekawostek uzasadniających, dlaczego to jest bzdura – osoby zainteresowane wnioskiem ostatecznym będą mogły przeskoczyć od razu na koniec drugiego odcinka, gdy się ukaże 🙂 ).
Zaczniemy od tego, że toksykologia (i medycyna) rozróżnia drogi wprowadzenia substancji do organizmu: wdychanie, połknięcie, wchłanianie przez błony śluzowe (tunależą np. czopki) oraz wstrzykiwanie: dożylnie, domięśniowo, dootrzewnowo i podskórnie. Działanie substancji może się drastycznie różnić przy różnych formach wprowadzenia, przykładowo wdychane opary rtęci są silnie szkodliwe, ale już rtęć wprowadzona do układu pokarmowego w postaci metalicznej (czyli pierwiastkowej) jest bardzo mało szkodliwa. „Lizanie” można tu chyba uznać za ten właśnie sposób, czyli połknięcie (podanie doustne), z uwzględnieniem tego, że oznacza też poddanie pierwiastka działaniu wody, która jest przecież głównym składnikiem śliny.
Bardzo istotna jest też postać chemiczna danego pierwiastka. Wiele metali jest mało reaktywnych w postaci litej, ale już rozdrobnienie zasadniczo zmienia sytuację. Poza tym część pierwiastków wykazuje tzw. alotropię – to znaczy występują w odmianach różniących się budową kryształu lub cząsteczki, co powoduje też istotne różnice we właściwościach fizycznych (np. w wyglądzie), ale także chemicznych. Przykładowo węgiel występuje jako diament o bardzo symetrycznej budowie krystalicznej oraz grafit o budowie mniej symetrycznej, a tak naprawdę dość specyficznej jak na niemetal, bo umożliwiającej przewodzenie prądu elektrycznego. Chyba każdy z nas wie, jakie są różnice w wyglądzie diamentu i grafitu…
Z kolei tlen występuje w atmosferze w postaci cząsteczek dwuatomowych (ditlen) oraz, rzadziej, cząsteczek trójatomowych (tritlen, powszechnie zwany ozonem). Dwuatomowy tlen jest bezbarwny, ozon niebieskawy, ale to nie jest najważniejsza różnica. Ozon jest o wiele bardziej reaktywny i bardziej toksyczny, dlatego jego obecność w dolnej warstwie atmosfery jest dla człowieka niebezpieczna (co innego w warstwie ozonowej, która znajduje się na wysokości 10-50 kilometrów nad powierzchnią Ziemi). Tymczasem gaz ten powstaje nie tylko podczas burzy oraz pracy urządzeń elektrycznych (ogólnie podczas iskrzenia, pod co można podciągnąć błyskawice), ale także w silnikach spalinowych, z których jest emitowany do środowiska. W miastach o dużym natężeniu ruchu samochodowego jest to istotny problem – może powstawać tzw. smog Los Angeles. Na potrzeby dalszych rozważań uznam, że rozpatrujemy pierwiastki w takiej formie, w jakiej występują najczęściej w przyrodzie lub w postaci chemicznie czystej (w przypadku pierwiastków, które w postaci rodzimej nie występują).
Wróćmy do naszego obrazka. Kod kolorystyczny jest w tym układzie okresowym niby oczywisty, ale nie do końca…
1. Czerwony
Czerwony oznacza „Naprawdę nie należy” i tu jest prawie w porządku, z tym jedynie wyjątkiem, że więcej pierwiastków powinno mieć czerwony kolor – o tym więcej szczegółów przy innych kolorkach. Na przykład bar jest bardzo reaktywnym pierwiastkiem, który reaguje z wodą (ślina!) z wydzieleniem gazowego wodoru i dużej ilości ciepła, tak że może dojść do zapłonu tego wodoru, a nawet wybuchu, jeśli zdąży się on zmieszać z powietrzem. Powstające przy tym rozpuszczalne związki baru są toksyczne, a będący głównym produktem wodorotlenek baru jest dodatkowo mocną zasadą, czyli jest silnie żrący – tak jak wodorotlenek sodu, wchodzący w skład popularnego „kreta”.
Z drugiej strony, jak już napisałem, toksyczność rtęci metalicznej przy połknięciu jest bardzo mała. Toksyczne są opary rtęci oraz związki rtęci, zwłaszcza tzw. związki rtęcioorganiczne, w których rtęć jest bezpośrednio połączona z podstawnikami organicznymi (np. węglowodorowymi, jak w dimetylortęci Hg(CH₃)₂).
W przypadku oznaczonych na czerwono litowców i berylowców nie ma wątpliwości – pierwiastki te, poza berylem, reagują gwałtownie z wodą, dając silnie żrące wodorotlenki. Beryl należy do najlżejszych metali, lecz z uwagi na budowę atomu jest mało reaktywny jak na pierwiastek drugiej grupy układu okresowego. Na powietrzu w temperaturze pokojowej pokrywa się warstewką tlenku, która chroni go przed dalszym utlenianiem (proces ten nazywa się pasywacją i zachodzi też np. w przypadku glinu). Oznacza to jednak, że liżąc beryl, tak naprawdę liżemy tlenek berylu, a ten jest o wiele bardziej niebezpieczny niż sam pierwiastek (ten jest mało toksyczny w postaci litej, natomiast bardzo szkodliwy w formie rozdrobnionej). Jony Be²⁺ są podobne do jonów magnezu, przez co mogą go wypierać z enzymów, uniemożliwiając ich działanie. Poza tym mały rozmiar kationów berylu umożliwia im wnikanie do tkanek, a nawet komórek, gdzie dezaktywują enzymy jądrowe, m.in. te, które uczestniczą w syntezie DNA. Dlatego pierwiastek ten jest tak niebezpieczny.
Arsen jest powszechnie znany jako szkodliwy pierwiastek – arszenik, czyli tlenek arsenu(III), jest bardzo popularną trucizną tak w rzeczywistości, jak i w literaturze kryminalnej (warto zauważyć, że problemem dla tłumaczy jest to, że zarówno sam pierwiastek, jak i arszenik nazywają się po angielsku arsenic – przy braku informacji kontekstowych prawidłowe tłumaczenie będzie utrudnione). Choć arsen pierwiastkowy nie reaguje z wodą, to na wilgotnym powietrzu matowieje. Jest klasyfikowany jako toksyczny i niebezpieczny dla środowiska. Człowiek może nabyć tymczasową odporność na zatrucie arsenem, spożywając przez dłuższy czas dawki mniejsze od szkodliwych. Jednak związki arsenu będą kumulować się w organizmie, powodując negatywne skutki w dłuższym okresie. Arsen wykryto we włosach Napoleona Bonaparte, który zmarł na zesłaniu – kiedyś podejrzewano, że wskutek otrucia. Istnieje jednak możliwość, że pierwiastek ten znalazł się w jego organizmie niejako samoistnie, gdyż związki arsenu stosowano w XIX wieku jako barwnik do zielonych tapet i werdiur (tkanin o dominującej barwie zielonej, przeznaczonych do pokrycia ścian). Przebywanie w pomieszczeniach pokrytych takimi tapetami lub tkaninami było równoznaczne z ekspozycją na toksyczne substancje…
Technet jest pierwiastkiem mającym wyłącznie radioaktywne izotopy, ale nie wykazuje toksyczności chemicznej. Nie odgrywa żadnej roli biologicznej w organizmach żywych – w badaniach na szczurach nie stwierdzono żadnych zmian w zachowaniu ani działaniu organów wewnętrznych nawet przy długotrwałym wprowadzaniu do organizmu. Technet wchłonięty przez polizanie zostałby szybko utleniony do łatwo rozpuszczalnego technetanu(VII) i wydalony z organizmu. (Niebezpieczeństwo stanowi natomiast, podobnie jak w przypadku rtęci, wdychanie pyłów pierwiastka. Technet wprowadzony do płuc może powodować nowotwory).
Do reszty pierwiastków zaznaczonych na czerwono nie mam uwag, może z wyjątkiem pytania, jak polizać fluor i chlor, które są gazami w warunkach normalnych (czyli w temperaturze pokojowej i pod ciśnieniem atmosferycznym).
2. Żółty
Żółty to „Być może to nie jest dobry pomysł”, jednak ta grupa zawiera wiele silnie szkodliwych pierwiastków. Przykładowo ołów przejawia toksyczność zarówno przy wdychaniu, jak i połknięciu – połknięty przedostaje się do krwiobiegu. Metaliczny antymon ma toksyczność podobną jak arsen.
Co do fosforu, wszystko zależy od odmiany alotropowej – fosfor biały jest, owszem, silnie toksyczny, ale już czerwony i pozostałe odmiany nie są. Przyczyną jest oczywiście różnica w budowie krystalicznej obu odmian: kryształ fosforu białego jest zbudowany z oddzielnych cząsteczek P₄, słabo związanych ze sobą, z czego wynika lotność i duża reaktywność. Inne odmiany alotropowe fosforu mają rozległe sieci krystaliczne, w których duże zbiory atomów są silnie związane ze sobą. Polizanie białego fosforu byłoby niebezpieczne dla zdrowia, więc ten pierwiastek powinien być oznaczony kolorem czerwonym.
Problem stanowi także lit, który co prawda jest dużo mniej reaktywny od cięższych przedstawicieli swojej grupy (noszącej łącznie nazwę litowców i niezawierającej wodoru), tak że nie trzeba go przechowywać w nafcie. Praktykuje się to jednak, a czasem przechowuje go w atmosferze mało reaktywnego gazu, np. argonu, gdyż na powietrzu lit pokrywa się żółtobiałym nalotem, który jest mieszaniną tlenku, wodorotlenku, węglanu (białe) i azotku litu (żółty). Tak na marginesie, lit jest jedynym pierwiastkiem, który reaguje z azotem atmosferycznym w temperaturze pokojowej – żaden inny nie rusza wysoce trwałej cząsteczki azotu (ta trwałość wynika z istnienia potrójnego wiązania N≡N).
Sód, potas, rubid i cez chciwie reagują ze składnikami powietrza: tlenem, dwutlenkiem węgla, parą wodną – reagowałyby zatem z wodą znajdującą się w ślinie tak jak bar, dając silnie żrące wodorotlenki. Ale tak samo reagowałby lit! I nie jest ważne, że sole litu nie są silnie trujące (stosuje się je nawet w medycynie do łagodzenia objawów choroby afektywnej dwubiegunowej) – podobnie jak w przypadku baru wodorotlenek litu jest żrący i tworzy silnie zasadowy roztwór. Jego połknięcie może spowodować podrażnienie błon śluzowych ust, gardła, przełyku i dróg pokarmowych, a nawet perforację przełyku i żołądka. Czyli lit powinien być na czerwono.
Selen z grupy tlenowców jest ważnym mikroelementem, jednak w nadmiarze jest silnie szkodliwy i powoduje tzw. selenozę. Jej objawami są czosnkowy zapach oddechu (selen występuje w czosnku!), sensacje żołądkowe, łysienie, zmęczenie, drażliwość, a w skrajnych przypadkach marskość wątroby, odma płuc i śmierć. Bezpieczna dopuszczalna dawka dobowa wynosi 400-800 μg – mikrogramów, czyli milionowych części grama; odpowiada to 0,0004-0,0008 g. Jednym liźnięciem z pewnością można wchłonąć większą dawkę, tylko że znów pojawia się tu kwestia postaci chemicznej. Selen pierwiastkowy w najczęściej występującej odmianie α (szary lub metaliczny) nie reaguje z wodą, natomiast odmiana β (selen czerwony) jest bardzo reaktywna i z wodą reaguje gwałtownie. Czyli w tym przypadku jest podobnie jak z fosforem.
Należący do tej samej grupy tellur jest uważany za lekko trujący. Choć jest mniej reaktywny niż selen, to połknięty, zwłaszcza w postaci rozdrobnionej, szybko przechodzi w dimetylotellur (CH₃)₂Te, co znacznie zwiększa jego toksyczność. Podobnie jak w przypadku selenu, zatrucie tellurem objawia się oddechem o zapachu czosnku (pochodzącym właśnie od dimetylotelluru). Stężenie 25 mg/m³ we wdychanym powietrzu stanowi poważnie zagrożenie dla życia. Powinien być oznaczony kolorem czerwonym.
Osm jest mało reaktywnym pierwiastkiem, zalicza się go do szeroko pojętych metali szlachetnych. Nie reaguje zatem z wodą, a w postaci litej nie reaguje też z powietrzem. Zasadniczo lizanie nierozdrobnionego osmu nie powoduje zatem zagrożenia (ale w postaci rozdrobnionej, zwłaszcza w podwyższonej temperaturze, osm łatwo przechodzi w lotny OsO₄, który jest silnie trujący). W tym przypadku skłaniałbym się raczej do oznaczenia kolorem zielonym.
Tor jest słabo radioaktywnym i reaktywnym chemicznie metalem, który na powietrzu w temperaturze pokojowej matowieje wskutek pokrywania się warstwą dwutlenku. W warunkach normalnych powoli reaguje z wodą, jednak większość jego związków jest bardzo słabo rozpuszczalna w wodzie, więc pierwiastek ten nie jest uważany za trujący. Podobnie jak w przypadku technetu, radioaktywność toru sprawia, że jest on silnie szkodliwy w przypadku wdychania, jednak wydaje się bezpieczny przy lizaniu. Można uznać, że powinien być zielony.
Uran jest radioaktywny i silnie trujący. Co prawda z wodą reaguje tylko w stanie rozdrobnionym, ale w tym miejscu po raz pierwszy musimy się zastanowić, jak długo trwa liźnięcie. Dokładniej chodzi o to, czy trwa na tyle długo, by człowiek w trakcie bezpośredniego kontaktu wchłonął szkodliwą dawkę promieniowania (bo wchłonięcie szkodliwej ilości samego pierwiastka będzie raczej mało prawdopodobne).
Pomiar stoperem przy 10 próbach dawał wyniki między 0,5 a 1 sekundą, więc można założyć, że przeciętne liźnięcie trwa jakieś ¾ sekundy. Jednak w przypadku najbardziej rozpowszechnionego w przyrodzie izotopu, uranu-238, głównym rodzajem promieniowania powstającego w wyniku przemian radioaktywnych są cząstki α (podobnie w przypadku toru). Jest to bardzo słabo przenikliwy rodzaj promieniowania, zatrzymywany przez skórę, więc podczas lizania nie wyrządziłoby ono szkód. Tu również skłaniałbym się raczej do koloru zielonego – przypominam, że nie rozważamy tu ogólnej szkodliwości pierwiastka, a jedynie kwestię, czy jego polizanie jest niebezpieczne.
Pierwiastki zielone zostaną omówione w drugim odcinku.
[Grafika wiodąca – EvolveFish, Chemistry is Just Like Cooking Don’t Lick the Spoon Kitchen Apron (evolvefish.com)]